
แนะนำโดย สภาสูติศาสตร์-นรีเวชวิทยาอเมริกัน
โรคถ่ายทอดทางพันธุกรรมเกิดจากความผิดปกติของยีน โดยมีโรคทางพันธุกรรมหลายโรคไม่ได้มีการแสดงความผิดปกติออกมาให้เห็น (normal phenotype) แต่คนนั้นมียีนที่กลายพันธุ์ (mutation) อยู่ในตัว ซึ่งเรียกว่าเป็นพาหะของโรค (carrier) ซึ่งอาจเป็นการได้รับยีนกลายพันธุ์นั้นมาจากรุ่นก่อนหน้าหรือเป็นการกลายพันธุ์ ที่เพิ่งเกิดขึ้นใหม่ (de novo) ซึ่งหากยีนกลายพันธุ์เหล่านี้ถูกส่งต่อไปยังบุตรอาจทำให้บุตรมีโอกาสผิดปกติได้
ดังนั้น การตรวจคัดกรองพาหะของโรคทางพันธุกรรม เพื่อหายีนที่มีความผิดปกติเพื่อให้ทราบข้อมูลว่าตนเองมียีนแฝงหรือไม่ (มีการกลายพันธุ์แต่ไม่แสดงอาการของโรค) ช่วยให้คู่สมรสที่ต้องการมีบุตรสามารถวางแผนการมีบุตร ทราบถึงความเสี่ยงก่อนการตั้งครรภ์ วางแผนการรักษาโดยใช้เทคโนโลยีด้านการเจริญพันธุ์ได้อย่างถูกต้อง เหมาะสม รวมไปถึงการตัดสินใช้สเปิร์มหรือไข่บริจาค (gamete donor)เพื่อลดความเสี่ยงการเกิดโรคที่อาจถ่ายทอดไปยังบุตรได้
โรคทางพันธุกรรมที่สามารถพบได้มากและมีความรุนแรง ได้แก่ โรคกล้ามเนื้ออ่อนแรง, กลุ่มโครโมโซมเอกซ์เปราะ, ภาวะฮีโมโกลบินผิดปกติ และ Cystic fibrosisทั้ง 4 โรคนี้เป็นโรคที่สภาสูติศาสตร์-นรีเวชวิทยาอเมริกัน (ACOG The American College of Obstetricians and Gynecologists) แนะนำให้ฝ่ายหญิงที่วางแผนจะมีบุตรทุกคนได้รับการตรวจคัดกรอง โดยแต่ละโรคนั้นมีลักษณะดังนี้
1.โรคกล้ามเนื้ออ่อนแรง Spinal Muscular Atrophy (SMA)
เป็นกลุ่มโรคทางพันธุกรรมที่มีลักษณะเฉพาะคือมีอาการกล้ามเนื้อลีบสลายไม่มีแรง เนื่องมาจากความผิดปกติหรือความเสื่อมของของเซลล์ประสาทสั่งการ (motor neuron) ส่งผลให้เกิดการสูญเสียการส่งสัญญาณจากไขสันหลังไปยังกล้ามเนื้อ นับเป็นโรคทางพันธุกรรมที่พบมากเป็นอันดับ 2 รองจากโรคธาลัสซีเมีย
โรค SMA เกิดจากอะไร
≥ ร่างกายของคนทั่วไปจะมียีน 2 ตัว ที่ผลิตโปรตีน SMN (SMN: Survivor Motor Neuron genes) เพื่อควบคุมระบบประสาทสั่งการกล้ามเนื้อ ได้แก่ SMN1 ซึ่งเป็นยีนหลักที่ผลิตโปรตีนและ SMN2 ซึ่งเป็นยีนที่ผลิตโปรตีนได้เพียง 10% โดยแต่ละยีนมีจำนวนคนละ 2 ชุด (copies) ซึ่งยีนทั้ง 2 ตั้งอยู่บนโครโมโซมคู่ที่ 5 (5q13) ซึ่งโรค SMA เกิดจากการกลายพันธุ์ (mutation) แบบ deletion ของยีน SMN1 ทำให้ได้โปรตีนที่สั้นกว่าปกติและไม่สามารถทำงานได้ เมื่อไม่มีโปรตีน SMN จึงทำให้ไม่สามารถสั่งการกล้ามเนื้อได้ ร่างกายจึงอ่อนแรงและสูญเสียความสามารถในการเคลื่อนไหว
อย่างไรก็ดี คนทั่วไปยังมียีน SMN2 เปรียบเสมือน ยีนสำรอง ซึ่งจำนวน copy อาจแตกต่างไปในแต่บุคคลมีรายงานว่าในคนที่มีความผิดปกติของยีน SMN1 ทั้ง 2 copies (homozygous deletion) แต่ไม่แสดงอาการ SMA เพราะมียีน SMN2 ถึง 5 copies แม้ว่าโปรตีนที่ได้จากยีน SMN2 จะทำงานได้เพียง 10-20 % เท่านั้นรูปแบบการถ่ายทอดทางพันธุกรรมของโรค SMA เป็นแบบยีนด้อย (autosomal recessive) (รูปที่1) คนที่เป็นพาหะจะมียีน SMN1 1 copy ซึ่งหากพ่อและแม่มียีนSMN1 คนละ 1 copy (SMA carrier)ลูกจะมีโอกาสเป็นโรคได้ถึง 1 ใน 4 นอกจากนี้ยังมี SMA carrier อีกรูปแบบเรียกว่า silent carrier คือ ตรวจพบว่ามียีน SMN1 2 copies เหมือนคนปกติ แต่ยีนทั้ง 2 copies ตั้งอยู่บนโครโมโซมแท่งเดียวกัน ส่วนอีกแท่งไม่มี SMN1 ที่ปกติเลย ในกรณีนี้บุตรมีโอกาสได้รับความผิดปกติเช่นเดียวกัน
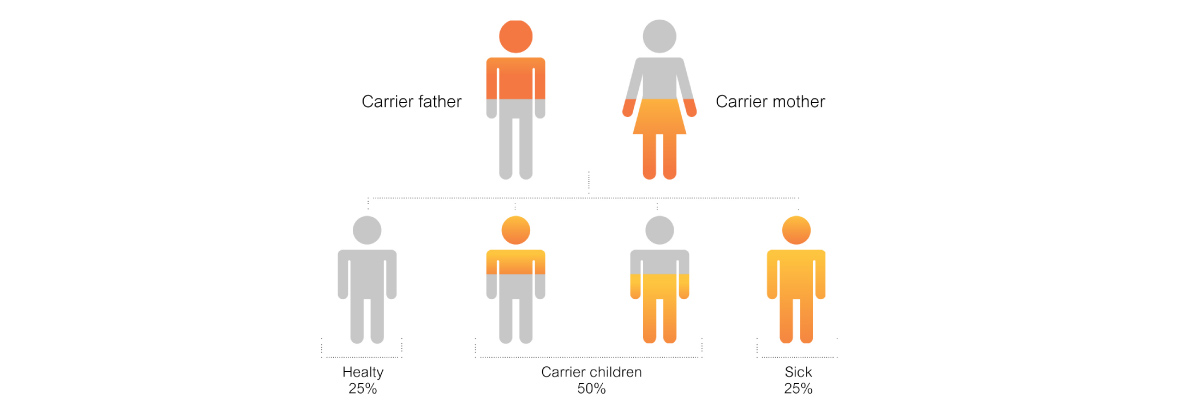
รูปที่ 1 รูปแบบการถ่ายทอดทางพันธุกรรมแบบยีนด้อยในกรณีที่พ่อและแม่เป็นพาหะทั้งคู่ มีโอกาสที่จะได้ลูกปกติไม่มียีนแฝงเลย 25% และได้ลูกปกติแต่มียีนแฝง 50% และมีโอกาสที่จะได้ลูกที่เป็นโรคถึง 25%
การตรวจทางพันธุศาสตร์
≥ ห้องปฏิบัติการพันธุศาสตร์ เจตนิน ให้บริการตรวจการขาดหายของยีน SMN1 (SMN1copy number analysis) ด้วยเทคนิค TaqMan qPCR ผู้ส่งตรวจสามารถเก็บเลือด 6-10 ml ใส่ใน standard EDTA tube ส่งที่ห้องปฏิบัติการพันธุศาสตร์ ระยะเวลาออกผล 7 วันทำการ
2. Fragile-X syndrome
กลุ่มอาการโครโมโซมเอกซ์เปราะเป็นภาวะพัฒนาการทางสติปัญญาช้า ซึ่งถ่ายทอดทางพันธุกรรมผ่าน โครโมโซมเอกซ์ ลักษณะอาการของคนที่เป็น Fragile-X syndrome คือ ระดับสติปัญญาปานกลางถึงต่ำ มีภาวะคล้าย autism สมาธิสั้นอยู่ไม่นิ่ง (attentiondeficit/hyper- activity) โดยอาการด้านสติปัญญาจะรุนแรงกว่าในเพศชาย
Fragile-X syndrome เกิดจากอะไร
≥ Fragile-X syndrome เกิดจากการกลายพันธุ์ของยีน fragile X mentalretardation-1 (FMR1) บนโครโมโซม X ตำแหน่ง q27.3 เป็นการกลายพันธุ์แบบมีชุดเบสซ้ำ คือ มีการเพิ่มจำนวนของชุดเบส Cytosine-GuanineGuanine (CGG) ซ้ำ ที่บริเวณส่วนต้นของยีน FMR1 (5’ UTR) การซ้ำของ CGG แบ่งได้เป็น 4 แบบ ตามจำนวนซ้ำ คือ
1.) น้อยกว่า 40 ชุด พบในคนปกติ
2.) 41-55 ชุด (intermediate) ยังไม่แสดงอาการ มีการถ่ายทอดไปยังบุตร
3.) 56-200 ชุด พบในคน ที่เป็นพาหะ เรียกว่า premutation
4.) CGG มากกว่า 200 ชุด พบในคนที่เป็นโรค (full mutation)
ความชุกของโรคในผู้ชายอยู่ที่ 1 ใน 4,000 และผู้หญิงอยู่ที่ 1 ใน 6,000-8,000 และหากเป็นภาวะพาหะพบในชาย 1 ใน 800 และ ในผู้หญิงถึง 1 ใน 100-200
3. Hemoglobiopathy
Hemoglobin (Hb) เป็นโปรตีนที่อยู่ภายในเม็ดเลือดแดงทำหน้าที่จับออกซิเจน Hb 1 หน่วยประกอบด้วย โปรตีน 4 สาย แบ่งเป็น สายแอลฟ่า (α-globin) 2 สาย และ เบต้า (β-globin) 2 สาย
ภาวะฮีโมโกลบินผิดปกติ (Hemoglobinopathy) แบ่งได้ 2 ประเภท คือ
1.) สร้างสายโกลบินได้น้อยลงหรือสร้างไม่ได้เลยเป็นภาวะโลหิตจาง (alpha-หรือ beta-thalassemia)
2.) ความผิดปกติด้านโครงสร้าง (Hb variants) จากการกลายพันธุ์ (mutation) แม้จะมีการสร้างโปรตีนได้ปกติ แต่โปรตีนเหล่านี้ไม่สามารถทำงานได้และส่งผลเสียต่อเซลล์ เช่น โรคเม็ดเลือดแดงรูปเคียว (Sickle cell anemia, Hb S) นอกจากนี้ยังมีรูปแบบการกลายพันธุ์ที่ทำให้โครงสร้างผิดปกติและสร้างได้น้อยลงด้วย (Thalassemic Hb variants) เช่น Hb Constant spring, Hb E และ Hb Paksé รูปแบบการถ่ายทอดทางพันธุกรรมของโรค เป็นแบบยีนด้อย (autosomal recessive)
การตรวจคัดกรองและการตรวจทางพันธุศาสตร์
≥ คู่สามีภรรยาที่วางแผนมีบุตรหรือภรรยาที่กำลังตั้งครรภ์ ควรได้รับการตรวจความสมบูรณ์ของเม็ดเลือดแดง จำนวน รูปร่าง ขนาด (Complete blood count,CBC) รวมไปถึงการตรวจหา thalassemia (Hb typing) โดยหาสัดส่วนของฮีโมโกลบินชนิดต่างๆเพื่อเป็นการคัดกรองในเบื้องต้น โดยเฉพาะคู่สามีภรรยาที่ตรวจว่ามีปริมาตรเซลล์เม็ดเลือดต่ำ (Meancorpuscular volume, MCV) น้อยกว่า 85 fL ควรมีการตรวจทางพันธุศาสตร์ เพื่อหายีนผิดปกติโดยตรง
เนื่องจาก thalassemia เป็นโรคทางพันธุกรรมที่พบได้เป็นอันดับหนึ่งและในบางประเภทมีความรุนแรงมาก การตรวจหาความผิดปกติของยีนทำได้โดยการใช้ mutiplex PCR และวิเคราะห์ผลโดย capillary electrophoresis ห้องปฏิบัติการพันธุศาสตร์ เจตนินให้บริการตรวจ alpha-thalassemia deletions – 7 variants ที่พบได้บ่อยในภูมิภาคนี้ ระยะเวลาออกผล 7-10 วัน
4. Cystic Fibrosis
Cystic fibrosis (CF) เป็นโรคทางพันธุกรรมที่ก่อให้เกิดความผิดปกติของเซลล์เยื่อบุ (epithelial cell) บริเวณทางเดินหายใจ ระบบสืบพันธุ์ ทางเดินอาหารโดยเฉพาะอย่างยิ่งตับและตับอ่อน ในปี 2001 เสนอให้มีการตรวจ CF ก่อนและระหว่างตั้งครรภ์ เพื่อลดความเสี่ยงที่เด็กจะมีภาวะทางเดินหายใจและตับอ่อนที่ผิดปกติ โดยจะพบมากในคน Caucasian ประมาณ1 ใน 2,500
CF มีสาเหตุมาจากการกลายพันธุ์ของยีน cystic fibrosis transmembrane regulator (CFTR) ซึ่งตั้งอยู่บนโครโมโซมคู่ที่ 7 ลักษณะการถ่ายทอดทางพันธุกรรมของโรค CF เป็นแบบยีนด้อย (autosomal recessive) ปัจจุบันพบกลายพันธุ์ในยีน CFTR มากกว่า 1,700 แบบแต่ที่พบบ่อยมี 23 แบบ อย่างไรก็ตามพบความชุกของโรคได้น้อยในประชากรเอเชีย
คำแนะนำเมื่อวางแผนมีบุตรและการตรวจคัดกรองทางพันธุกรรม
ตามคำแนะนำของ The American College of Obstetricians and Gynecologists (ACOG) ให้คำแนะนำการตรวจพาหะของโรคทางพันธุกรรม ดังนี้
1. ก่อนการตั้งครรภ์คู่สามีภรรยาควรเข้ารับการตรวจพาหะโรคทางพันธุกรรม
2. หากสามีหรือภรรยาฝ่ายใดฝ่ายหนึ่งตรวจพบว่าเป็นพาหะ ควรมีการตรวจคู่สมรสอีกฝ่ายเพื่อวางแผนการมีบุตรและประเมินความเสี่ยง
3. หากตรวจพบว่าเป็นพาหะทั้งคู่ การตรวจติดตามในระหว่างตั้งครรภ์ (prenatal diagnosis)อย่างใกล้ชิดมีความสำคัญ เพื่อลดความเสี่ยงจากการที่ลูกจะได้รับการถ่ายทอดยีนจากพ่อหรือแม่หรือทั้งคู่
4. เมื่อตรวจพบว่าตนเองเป็นพาหะของโรคทางพันธุกรรม ควรแนะนำให้ญาติตรวจด้วยเนื่องจากมีความเสี่ยงที่จะเป็นพาหะเช่นเดียวกันแต่ละคนสามารถมียีนแฝงของโรคทางพันธุกรรมที่ก่อให้เกิดโรค หากมีการตรวจคัดกรองยีนและทราบว่าตนเองมียีนแฝงหรือไม่ จะได้มีการวางแผนอย่างมีประสิทธิภาพและเตรียมพร้อมสำหรับการมีบุตรเพื่อความปลอดภัยทั้งของแม่และเด็ก
บทความโดย
คุณศิวะเดช ชูดวง
นักวิทยาศาสตร์, ห้องปฏิบัติการพันธุศาสตร์ โรงพยาบาลเจตนิน
วารสารวิชาการเจตนิน Vol.11 No.1
